为了解决这一难题,可以使用轻质小分子化合物作为储氢材料。在众多的化学储氢材料中,肼(N2H4)中氢的质量分数高达12.5%,完全分解产物为H2和N2,是一种理想的液体氢源。缺点是肼与金属催化剂接触时易发生爆炸,存在一定的安全隐患。水合肼(N2H4·H2O)作为肼的水合物,其完全分解产物与肼相同,可释氢质量分数为8.0%,其中H2O分子不参与反应,化学性质稳定,且室温下呈稳定液态存在,便于安全地储存和运输,是一种颇具应用前景的化学储氢材料。在合适催化剂作用下,水合肼可完全分解产生H2和N2,但在水合肼分解制氢过程中常伴生副产物NH3,导致氢选择性降低。因此,开发高氢选择性、高活性、高稳定性的肼类分解催化剂是实现水合肼作为储氢材料研究的关键。
现阶段,肼类分解催化剂主要应用于航天飞行器姿轨控发动机上,用以改变其飞行轨道或调整飞行姿态,在姿态控制领域具有重要应用[3,4]。早在20世纪60年代初,美国Shell公司成功研发出Shell-405催化剂,该催化剂是活性金属Ir担载在RA-1型Al2O3载体上制备而成的,主要应用于当时的ATS-4技术卫星上。此后,肼催化分解技术在单组元推进小型姿态控制发动机中得到了广泛应用。近年来,非贵金属(Fe、Co和Ni等)也被用于制备肼类分解催化剂[5~7],但无论是贵金属或非贵金属,单元金属催化剂的活性、制氢选择性或耐久性均较低。研究[8~25]发现,采用双元或多元复合金属催化剂可有效解决上述问题,尤其纳米镍基合金催化剂Ni-M (M = Ir、Pt、Mo、Fe等),可显著改善单元金属催化剂的综合性能。尽管在此方面的研究已取得了积极进展,但迄今已报道的镍基合金催化剂的性能仍存在明显不足,如催化剂的活性较低,且部分催化剂的制氢选择性特别是宽温域条件下低于99%,这严重制约了N2H4·H2O制氢体系的进一步推广应用。
本工作以N2H4·H2O催化分解制氢体系为研究对象,结合航天用肼类分解催化剂生产工艺技术,以Al2O3为载体,以Ni-Ir为活性组分,开展兼具高催化活性、高制氢选择性的N2H4·H2O催化分解制氢用催化剂的制备及性能研究。选择Al2O3作为载体是因为其孔隙率高、密度低,在本工作反应条件下具有良好的热稳定性和化学稳定性。前期开展的航天肼类分解催化剂制备技术研究结果表明,在载体浸渍-焙烧过程中,活性组分Ni和Ir的前驱体氧化物将被同时引入载体孔隙或表面上,在还原气氛下进行热处理后,沉积的活性金属氧化物将转变成小粒径的Ni-Ir合金,并均匀地负载于Al2O3载体上。结合N2H4·H2O催化分解制氢性能评价实验对配方进行筛选和优化,最终制备出性能优异的负载型颗粒状水合肼催化分解制氢用催化剂(Ni-Ir/Al2O3)。N2H4·H2O催化分解反应动力学方程及活性衰减原因的初步探索,为N2H4·H2O催化分解制氢体系的应用奠定了一定的技术基础,并为N2H4·H2O催化分解机理和失活机制研究提供一定的理论依据。
1 实验方法
1.1 实验试剂和仪器
实验试剂:六水合氯铱酸(H2IrCl6·6H2O,Ir含量≥35%),六水合氯化镍(NiCl2·6H2O,纯度98%),NaOH (纯度96%),拟薄水铝石(工业级),田菁粉(工业级),HNO3 (分析纯)。实验室用水全部为去离子水。
实验仪器:双螺杆挤条机(FD-26),管式炉(OTF-1200),马弗炉(KSL-1200),烘箱。
1.2 催化剂制备
首先,以拟薄水铝石为前驱体,以田菁粉为助挤剂,在HNO3水溶液作用下混合均匀形成胶团,经混捏后由双螺杆挤条机挤条成型,在120℃进行干燥后置于管式炉中经700℃高温焙烧活化1.0 h,得到Al2O3载体。将载体经裁切-粉磨处理后,制成直径1.7~2.2 mm、长(2.0 ± 0.5) mm的圆柱状载体。
其次,采用简单的浸渍-焙烧-还原工艺制备Ni-Ir/Al2O3催化剂,通过调节金属前驱体浸渍液浓度及浸渍-焙烧次数控制所制备Ni-Ir/Al2O3负载量约为10% (质量分数)。按照催化剂配方设计中金属元素比例的需求,称取定量摩尔比的NiCl2·6H2O、H2IrCl6·6H2O溶解后定容于容量瓶中。将一定质量Al2O3载体浸渍于该金属前驱体混合溶液中,吸收完全后于120℃干燥2 h,将样品转移至管式炉中于空气气氛下400℃焙烧2 h。重复浸渍-焙烧工序直至达到所需活性金属负载量后,于H2气氛下400℃还原处理2 h。待还原处理完成后冷却至室温,再通空气进行老化处理,即可制备得到Ni-Ir/Al2O3催化剂,所制备催化剂应置于惰性气氛手套箱中进行贮存。本实验制备出Ni100 - x Ir x /Al2O3系列催化剂,其中x = 0、0.1、1、10、20、40、60、80、100。
1.3 催化剂表征
实验采用D/Max 2550VB/PC X射线衍射仪(XRD)分析载体及催化剂的物相;采用JEM-2100F透射电子显微镜(TEM)观察催化剂的微观结构;采用ESCALAB 250xi X射线光电子能谱(XPS)测定催化剂元素化学状态;使用Micromeritics ASAP 2460氮气物理吸附仪(BET)对催化剂样品进行等温吸附/脱附测试,测量得到催化剂及其载体的孔径分布和比表面积;采用Agilent 7890气相色谱仪对水合肼分解产生的气体组成进行检测;采用AutoChem II 2920化学吸附仪中氢气程序升温脱附(H2-TPD)分析N2H4·H2O分解反应前后催化剂吸附H2的强度和吸附量来表征其失活现象。
1.4 催化剂性能测试
N2H4·H2O催化分解制氢反应性能测试在间歇反应器中进行,通过排水收集气体法装置测定[8]。测试过程中,将三口圆底烧瓶置于带加热恒温功能的磁力搅拌器上,以保持恒定温度。反应起始前将适量催化剂放置于烧瓶内并加入磁子搅拌,催化反应时将一定量水合肼溶液通过与反应器相连的针筒快速注入反应器内,反应过程中通过磁力搅拌使催化剂与N2H4·H2O混合均匀,并通过调节加热功率维持温度稳定。催化反应开始后,将N2H4·H2O溶液催化分解产生的气体先经过内装盐酸溶液的洗气瓶,用以除去反应可能产生的NH3,再通入含水的反接洗气瓶中,气体产生的压力会将洗气瓶中的水排出至放在天平上的量筒中。通过天平实时记录排出水的质量,经换算将水的质量转化为催化分解产生的N2和H2量,即可计算得知催化剂的制氢选择性及催化活性。
水合肼催化分解反应的方程式为:
其中,y为氢气选择性,y = (3λ - 1) / 8,λ为反应产生的气体(N2 + H2)与N2H4的摩尔比,λ =
以单位时间内转化N2H4·H2O的量来反映其催化反应速率,反应转化率为50%时记录反应时间计算活动反应速率r,h-1。
催化剂循环性能测试方法为:采用N2H4·H2O催化分解制氢反应性能测试方法,每次反应结束后,重新加入N2H4·H2O进行循环性能测试,通过计算催化活性保留值对其耐久性进行评估[13]。
2 实验结果和讨论
2.1 催化剂结构表征
由Ni100- x Ir x /Al2O3系列催化剂样品的TEM像(图1)可以看出,催化剂颗粒呈团聚状,载体上均匀分布着平均粒径为2~4 nm的Ni-Ir活性金属,主要由晶面取向随机的微小纳米晶或非晶相组成。由Ni100- x Ir x /Al2O3系列催化剂的XRD谱(图2)可以看出,所有样品均在37.4° (311)、45.8° (400)和67.3° (441)出现γ-Al2O3 (PDF No.04-0880)的衍射峰,表明催化剂中Al2O3载体为γ相晶体结构。对于Ni/Al2O3催化剂,在2θ = 44.61°、52.02°和76.61°处出现明显衍射峰,分别对应金属Ni (PDF No.04-0850)的(111)、(200)和(220)特征峰;对于NiIr0.1/Al2O3和Ni90Ir10/Al2O3同样出现了较为明显的Ni衍射峰,由于Ni所占比例的降低导致其衍射峰强度逐渐减弱,同时由于活性金属组分Ir的引入,NiIr0.1/Al2O3 (44.55°、51.97°和76.30°)和Ni90Ir10/Al2O3 (44.50°、51.62°和76.27°)中Ni的衍射峰向低角略有偏移。该现象表明催化剂中较小的Ni原子被较大的Ir原子替代导致Ni晶格发生膨胀,使得金属Ni晶面衍射峰向低角略有偏移。对于所有的Ni100 - x Ir x /Al2O3系列催化剂,其XRD谱中并没有发现明显的活性金属Ir特征峰,分析原因为活性组分Ir以较小颗粒高度均匀地分散在载体表面,较难通过XRD检测到明显的Ir金属衍射峰。总之,催化剂XRD测试结果表明,该Ni-Ir/Al2O3催化剂中的活性组分是以Ni-Ir合金形式存在的。
图1
图1
Ni100 - x Ir x /Al2O3系列催化剂的TEM像
Fig.1
TEM images of Ni100 - x Ir x /Al2O3 catalysts samples (d—diameter of particle)
(a) Ni/Al2O3 (b) Ni80lr20/Al2O3 (c) Ni60lr40/Al2O3 (d) Ni40lr60/Al2O3 (e) Ni20lr80/Al2O3 (f) lr/Al2O3
图2
图2
Ni100 - x Ir x /Al2O3催化剂XRD谱
Fig.2
XRD spectra of Ni100 - x Ir x /Al2O3 catalysts samples
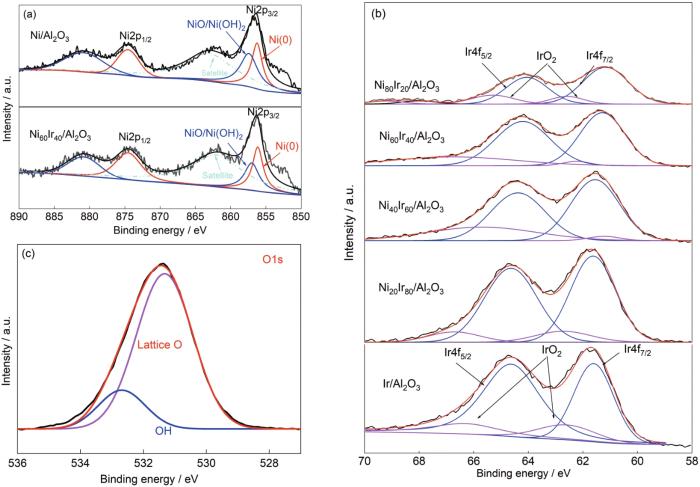
为了确定Ir、Ni和O元素的化学状态,采用XPS对Ni100 - x Ir x /Al2O3催化剂样品进行了表征(图3)。在Ni100 - x Ir x /Al2O3催化剂中,金属态Ir (Ir4f7/2 61.14~61.64 eV)和Ni (Ni2p3/2 856.0 eV)与氧化态Ir (IrO2, Ir4f7/2 62.5 eV)和Ni (NiO/Ni(OH)2,Ni2p3/2 857.0 eV)共存于样品中,氧化态的Ni和Ir可能是由于老化过程中表面暴露于空气所造成的局部氧化。由图3a可以看出,纯Ni/Al2O3中的Ni2p轨道电子能谱与Ni60Ir40/Al2O3中的基本一致,表明活性组分合金化后并没有改变Ni2p轨道电子结合能。而图3b中,随着Ir在催化剂中含量降低,其电子能谱峰强度逐渐减弱,同时Ir4f轨道的电子结合能由61.64 eV (Ir/Al2O3)降低至61.14 eV (Ni80Ir20/Al2O3),降低了约0.5 eV,这表明Ni-Ir合金化后,Ir4f轨道的电子排布发生了改变。
图3
图3
Ni100 - x Ir x /Al2O3催化剂样品XPS测试结果
Fig.3
XPS results of Ni100 - x Ir x /Al2O3 catalysts
(a) Ni2p (b) Ir4f (c) O1s
另外,O1s谱可以分解成峰值为531.0和532.5 eV 2个峰,分别对应于金属氧化物的晶格氧(NiO/Ni(OH)2、IrO2和Al2O3)以及少量的羟基基团(—OH)。据文献[25]报道,羟基基团有利于N—H键的断裂,从而有利于提高催化剂制氢选择性。
图4
图4
Al2O3载体和Ni60Ir40/Al2O3催化剂样品的N2吸/脱附等温线曲线
Fig.4
N2 adsorption/desorption isotherm curves of Al2O3 carrier and Ni60Ir40/Al2O3 catalyst (STP—standard temperature and pressure, P is the partial pressure of nitrogen, and P0 is the saturated vapor pressure of nitrogen at liquid nitrogen temperature)
表1 Al2O3载体和Ni60Ir40/Al2O3催化剂样品BET测试结果
Table 1
| Sample | Specific surface area / (cm2·g-1) | Pore volume / (mL·g-1) | Pore diameter / nm |
|---|---|---|---|
| Al2O3 | 195.25 | 0.33 | 5.3 |
| Ni60Ir40/Al2O3 | 171.83 | 0.28 | 4.8 |
2.2 催化剂配方筛选
图5
图5
Ni100 - x Ir x /Al2O3催化N2H4·H2O分解制氢性能及Ir含量对催化活性及制氢选择性的影响
Fig.5
Time course profiles for the N2H4·H2O decomposition over the Ni100 - x Ir x /Al2O3 catalysts (a) and effect of Ir content (molar ratio) in the catalyst on the reaction rate (r) and H2 selectivity (b) (
表2 Ni100 - x Ir x /Al2O3系列催化剂催化N2H4·H2O分解性能数据对比
Table 2
| Catalyst sample | H2 selectivity / % | r / h-1 |
|---|---|---|
| Ni/Al2O3 | 88.38 | 2.8 |
| NiIr0.1/Al2O3 | > 99 | 10.7 |
| Ni99Ir1/Al2O3 | > 99 | 47.4 |
| Ni90Ir10/Al2O3 | > 99 | 109.8 |
| Ni80Ir20/Al2O3 | > 99 | 125.0 |
| Ni60Ir40/Al2O3 | > 99 | 249.2 |
| Ni40Ir60/Al2O3 | 96.25 | 321.4 |
| Ni20Ir80/Al2O3 | 21.03 | 642.9 |
| Ir/Al2O3 | 8.58 | 725.8 |
由图5可知,双元Ni-Ir/Al2O3的N2H4·H2O催化分解活性均高于单金属催化剂Ni/Al2O3。其中,Ni/Al2O3催化活性约为2.8 h-1,制氢选择性约为88.38%,而Ir/Al2O3催化N2H4·H2O分解活性最好,但其制氢选择性仅为8.58%。由此可见,通过向镍基催化剂中引入适量金属Ir即可以明显提升催化剂的综合性能,且随着催化剂中Ir含量逐渐增大,其催化反应速率不断增大,而制氢选择性呈先增大后减少的趋势。该结果也与Ni100 - x Ir x /Al2O3催化剂中Ir4f的XPS测试结果一致,即Ni-Ir合金化在一定程度上改善了活性组分Ir的电子排布,使得Ir4f轨道中心发生迁移,从而有效改善了催化剂电子结构和几何构型,进而强化了N2H4·H2O催化分解制氢选择性,由8.58%增大至99%以上。
研究结果表明,Ni60Ir40/Al2O3催化剂的综合性能最佳,在303 K条件下其催化活性可以达到249.2 h-1,制氢选择性可达99%以上。采用气相色谱仪对Ni60Ir40/Al2O3催化剂催化N2H4·H2O分解产生的气体进行检测,发现其H2/N2摩尔比约为1.99,这也进一步证实该催化剂制氢选择性接近100%。
2.3 Ni60Ir40/Al2O3 催化N2H4·H2O分解制氢性能及其反应动力学
2.3.1 反应温度
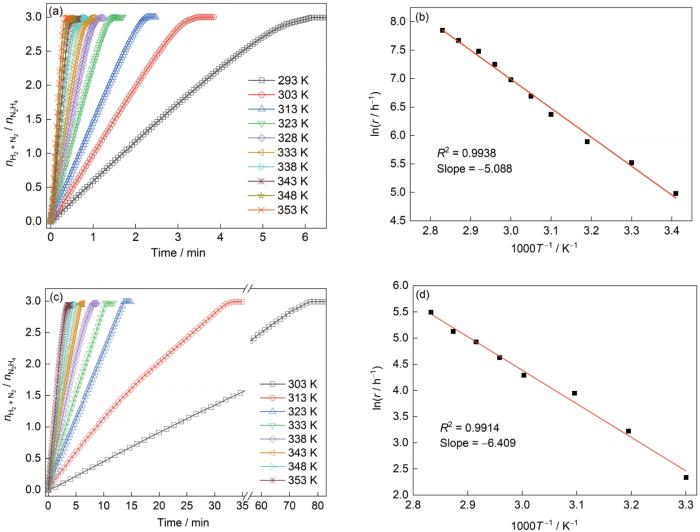
由于N2H4·H2O催化分解反应为放热反应,催化反应过程中积累的热量会引起反应溶液温度升高,因此研究反应温度对N2H4·H2O催化分解制氢性能的影响至关重要[29]。图6a和c分别是不同反应温度对Ni60Ir40/Al2O3和NiIr0.1/Al2O3催化N2H4·H2O分解制氢性能的影响。由图可知反应速率随着反应温度的升高而加快,符合一般化学反应规律[23]。根据Arrhenius方程对不同温度下的反应速率进行计算(图6b和d)可知,Ni60Ir40/Al2O3和NiIr0.1/Al2O3催化N2H4·H2O分解反应的活化能分别为42.3和53.3 kJ/mol。由此可见,在催化剂中引入Ir能够有效降低水合肼催化分解时的活化能,故Ni60Ir40/Al2O3较NiIr0.1/Al2O3表现出更为优异的催化分解活性。值得注意的是,当反应温度在293~353 K区间时,除NiIr0.1/Al2O3催化剂在高温处选择性略微降低外,Ni60Ir40/Al2O3催化N2H4·H2O分解制氢选择性均大于99%,说明该催化剂的制氢选择性与催化反应温度没有关联性。这有助于降低实际应用过程中N2H4·H2O制氢装置对温度控制方面的要求[8]。
图6
图6
反应温度对Ni60Ir40/Al2O3和NiIr0.1/Al2O3催化N2H4·H2O分解制氢性能的影响,以及利用Arrhenius方程求解其活化能时的反应速率
Fig.6
Effects of reaction temperature on N2H4·H2O decomposition in the presence of Ni60Ir40/Al2O3 (a) and NiIr0.1/Al2O3 (c), and the responding reaction rates for the activation energy determination according Arrhenius equation (R2—goodness of fit) (b, d)
2.3.2 N2H4·H2O浓度
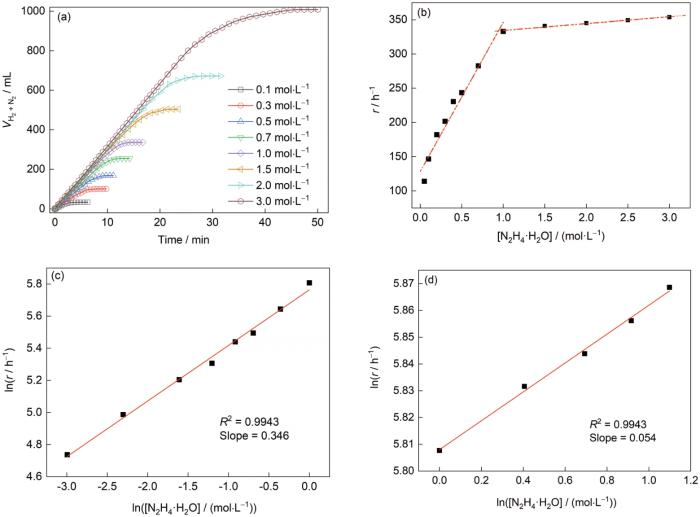
图7a为303 K时N2H4·H2O浓度在0.05~3.0 mol/L区间内N2H4·H2O分解动力学曲线,图7b为不同N2H4·H2O浓度与其催化分解反应速率的拟合线性关系。图7a中不同N2H4·H2O浓度下所有反应生成的气体体积(
图7
图7
不同浓度N2H4·H2O催化分解生成的气体体积(
Fig.7
Time profiles for the total gas volume (
2.3.3 助剂NaOH浓度
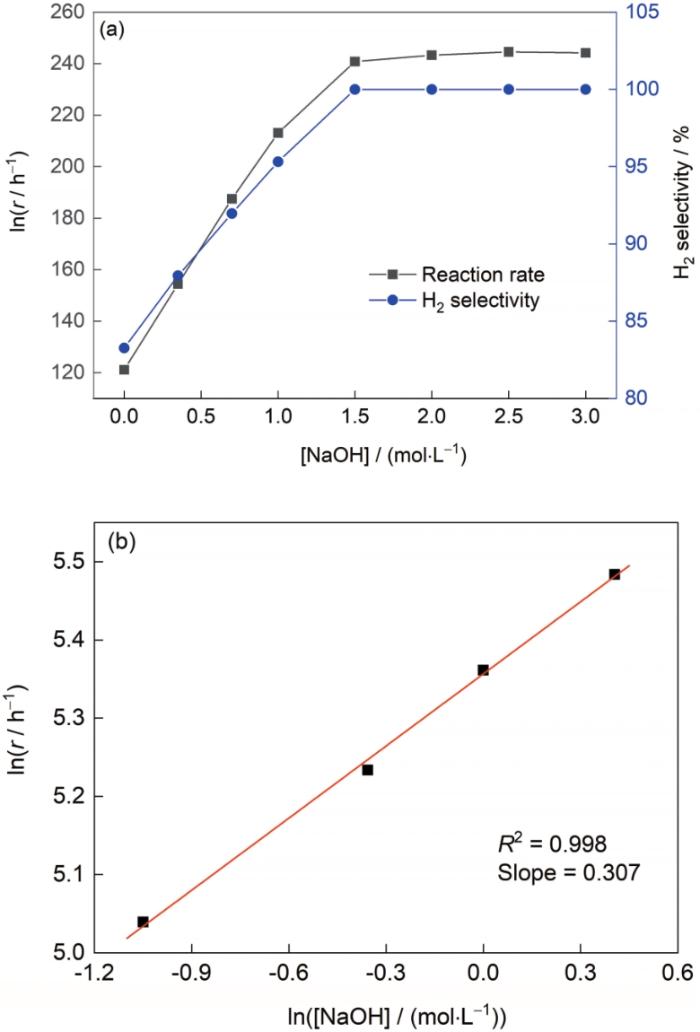
在N2H4·H2O催化分解反应中,适量引入NaOH或KOH能明显提高反应活性和制氢选择性[16~19]。图8a为NaOH浓度对Ni60Ir40/Al2O3催化N2H4·H2O分解反应速率和制氢选择性的影响。可以看出,随着NaOH浓度提高,催化剂的催化活性与制氢选择性不断增加,这与文献[30]结果一致;在NaOH浓度为1.5 mol/L时,催化反应速率达到241.0 h-1,制氢选择性为100%;之后继续增加NaOH浓度,催化反应速率和制氢选择性变化不大。通过拟合lnr与ln[NaOH]关系曲线(图8b)可知,在NaOH高浓度区间内N2H4·H2O催化分解反应的反应级数为0,而在NaOH低浓度区间内催化分解反应的反应级数为0.307。
图8
图8
NaOH浓度对Ni60Ir40/Al2O3催化N2H4·H2O分解反应制氢的影响,及lnr对ln[NaOH]的拟合关系
Fig.8
Effects of NaOH concentration on N2H4·H2O decomposition in the presence of Ni60Ir40/Al2O3 (a) and a plot of lnr vs ln[NaOH] (b)
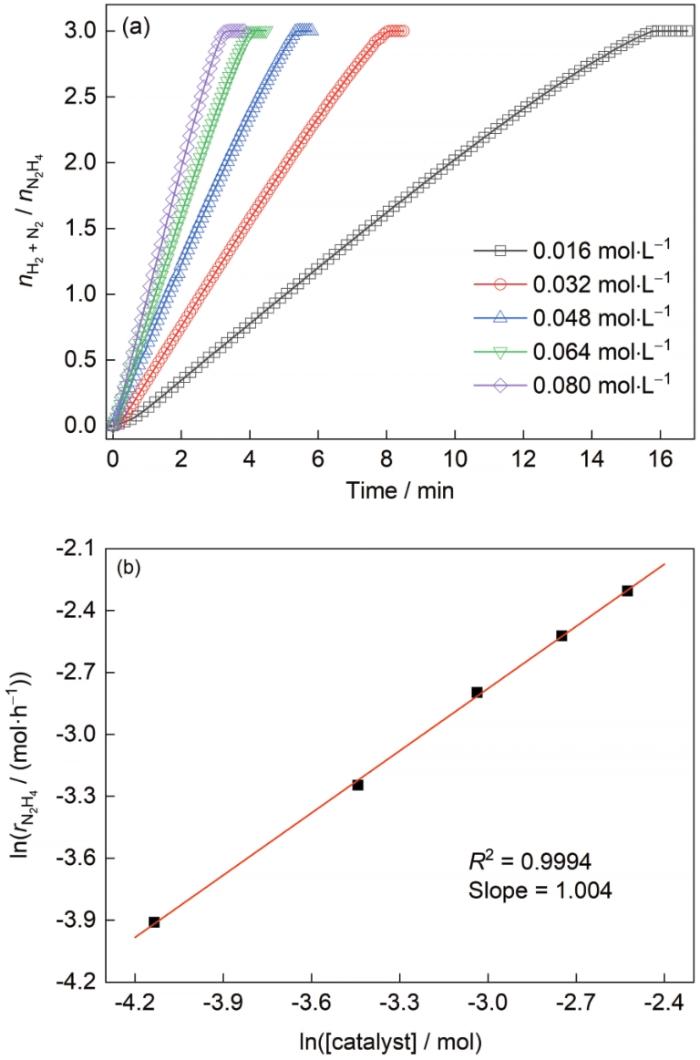
2.3.4 催化剂浓度
图9
图9
Ni60Ir40/Al2O3催化剂浓度对N2H4·H2O催化分解反应速率的影响,及
Fig.9
Effects of catalyst concentration on N2H4·H2O decomposition in the presence of Ni60Ir40/Al2O3 (a) and a plot of
2.3.5 N2H4·H2O催化分解反应动力学方程
根据以上各部分实验研究结果,经拟合计算可以得到Ni60Ir40/Al2O3催化N2H4·H2O分解反应的动力学方程:r = -k[N2H4·H2O]0.346/0.054[NaOH]0.307[Catalyst]1.004,k = 4.62 × 109exp(-5088.49 / T)。
此方程反映了多种反应条件对N2H4·H2O催化分解反应速率的影响,可以描述Ni60Ir40/Al2O3催化N2H4·H2O分解反应的动力学规律。该方程对于N2H4·H2O制氢体系机理研究和实际应用具有重要指导意义。
2.4 Ni60Ir40/Al2O3 催化N2H4·H2O分解制氢循环耐久性
图10a为Ni60Ir40/Al2O3催化N2H4·H2O分解制氢循环耐久性的测试曲线。可以看出,在303 K条件下经过5 cyc循环反应后,Ni60Ir40/Al2O3催化剂仍展现出优异的制氢选择性(> 99%),而其N2H4·H2O催化反应速率略有衰减,由249.2 h-1减小至225.0 h-1,活性衰减约9.7%。
图10
图10
Ni60Ir40/Al2O3催化N2H4·H2O分解制氢循环耐久性测试曲线和反应前后催化剂的H2-TPD曲线
Fig.10
Durability test for H2 generation from N2H4·H2O over Ni60Ir40/Al2O3 catalyst (a) and the H2-TPD profiles of fresh and post-used catalysts (b) (TPD—temperature programmed desorption)
图10b为Ni60Ir40/Al2O3催化N2H4·H2O分解前后的H2-TPD曲线。反应前后催化剂样品均出现2个H2脱附峰,一般认为(I)类低温峰对应与载体相互作用较强的部分活性中心Ir-Ni吸附的氢,而(Ⅱ)类高温峰对应于体相活性组分中心吸附的氢[31]。可以看出,N2H4·H2O催化分解反应后,催化剂上(I)类中心和(Ⅱ)类中心均略有减少。这表明活性金属在催化水合肼分解制氢反应过程中,活性组分Ni-Ir发生了团聚或脱落,致使Ni-Ir纳米粒子粒径增大或含量降低,从而引起与载体相互作用较强的活性物种数目减少,导致吸附峰强度减弱。此外,新鲜态Ni60Ir40/Al2O3催化剂上的氢脱附峰顶温度分别为122和420 K,催化反应后的H2脱附温度分别升高至163和445 K。这表明新鲜催化剂中的活性金属粒子较小,与载体相互作用较强,使得吸附氢在较低的温度下就可脱附,反应后活性金属粒子变大,与载体的相互作用减弱,对氢的吸附更强,致使脱附温度升高。由此可以认为,Ni60Ir40/Al2O催化剂经多次循环后催化活性略有衰减,主要是因为N2H4·H2O催化分解反应过程中,活性组分Ni-Ir纳米粒子发生了团聚,使得催化剂中有效活性位减少而导致的。
3 结论
(1) 采用简单的浸渍-焙烧-还原工艺成功制备了负载型Ni-Ir/Al2O3颗粒状催化剂,通过优化催化剂中Ni、Ir金属含量的比例,确定Ni60Ir40/Al2O3催化剂综合性能最佳,在303 K条件下催化N2H4·H2O分解的反应速率可以达到249.2 h-1,制氢选择性高达99%以上。
(2) 对Ni60Ir40/Al2O3催化N2H4·H2O分解反应的动力学及循环耐久性研究结果表明,反应温度、N2H4·H2O浓度、NaOH浓度和催化剂用量对反应速率影响显著,具体为:
① 反应温度升髙,N2H4·H2O催化分解速率加快,而其制氢选择性基本不受温度影响,根据Arrhenius方程可得Ni60Ir40/Al2O3催化N2H4·H2O分解的活化能为42.3 kJ/mol,低于NiIr0.1/Al2O3的反应活化能。
② 随着N2H4·H2O浓度升高,催化分解制氢反应速率加快,N2H4·H2O催化分解反应在高N2H4·H2O浓度区间内反应级数接近零级,在低N2H4·H2O浓度区间内反应级数为0.37级。
③ 在低NaOH浓度区间内(0~1.5 mol/L),随着NaOH浓度升高,反应速率加快,制氢选择性升高,反应级数为0.31级;在高NaOH浓度区间内(≥ 1.5 mol/L),其催化反应速率不受NaOH浓度影响,反应级数接近零级。
④ 随着催化剂浓度增大,N2H4·H2O催化分解速率加快,且对比催化剂浓度,N2H4·H2O催化分解反应的反应级数为1级。
⑤ 循环5 cyc后,催化剂仍展现出优异的制氢选择性(> 99%)和N2H4·H2O催化分解反应活性(反应速率衰减仅为9.7%),其活性衰减原因为活性组分Ni-Ir纳米粒子发生团聚而导致反应活性位减少引起的。
(3) Ni60Ir40/Al2O3催化N2H4·H2O分解反应动力学方程r = -k[N2H4·H2O]0.346/0.054[NaOH]0.307[Catalyst]1.004,其中k = 4.62 × 109exp(-5088.49 / T)。
参考文献
Preparation of iridium catalyst and its catalytic activity over hydrazine hydrate decomposition for hydrogen production and storage
[J].
Recent advances in liquid-phase chemical hydrogen storage
[J].
Evaluation of Ir/Al2O3, Ir-Ru/Al2O3 and Ru/Al2O3 catalyst performance in a 5 N satellite thruster
[J].
Iridium-decorated multiwall carbon nanotubes and its catalytic activity with Shell 405 in hydrazine decomposition
[J].
Noble-metal-free NiCu/CeO2 catalysts for H2 generation from hydrous hydrazine
[J].
La(OH)3-decorated NiFe nanoparticles as efficient catalyst for hydrogen evolution from hydrous hydrazine and hydrazine borane
[J].
Retraction: Mesoporous multiwalled carbon nanotubes as supports for monodispersed iron-boron catalysts: Improved hydrogen generation from hydrous hydrazine decomposition
[J].
Structural and catalytic properties of supported Ni-Ir alloy catalysts for H2 generation via hydrous hydrazine decomposition
[J].
Catalytic decomposition of hydrous hydrazine over Ni-Pt/La2O3 catalyst: A high-performance hydrogen storage system
[J].
Pd-Ni nanoparticles supported on reduced graphene oxides as catalysts for hydrogen generation from hydrazine
[J].
Tuning the surface composition of Ni/meso-CeO2 with iridium as an efficient catalyst for hydrogen generation from hydrous hydrazine
[J].
Defective crystalline molybdenum phosphides as bifunctional catalysts for hydrogen evolution and hydrazine oxidation reactions during water splitting
[J].
Bimetallic NiIr nanoparticles supported on lanthanum oxy-carbonate as highly efficient catalysts for hydrogen evolution from hydrazine borane and hydrazine
[J].
Optimal Co-Ir bimetallic catalysts supported on γ-Al2O3 for hydrogen generation from hydrous hydrazine
[J].
NiIr nanoparticles immobilized on the pores of MIL-101 as highly efficient catalyst toward hydrogen generation from hydrous hydrazine
[J].
Study of formation mechanism of Ni-Pt/CeO2 catalyst for hydrogen generation from hydrous hydrazine
[J].
Nanoscale MIL-101 supported RhNi nanoparticles: An efficient catalyst for hydrogen generation from hydrous hydrazine
[J].
Nickel-platinum nanoparticles immobilized on graphitic carbon nitride as highly efficient catalyst for hydrogen release from hydrous hydrazine
[J].
Bimetallic Ni-Pt nanoparticles immobilized on mesoporous N-doped carbon as a highly efficient catalyst for complete hydrogen evolution from hydrazine borane
[J].
Silica supported ternary NiRuPt alloy nanoparticles: Highly efficient heterogeneous catalyst for H2 generation via selective decomposition of hydrous hydrazine in alkaline solution
[J].
Tuning surface composition of Ni-Pt/CeO2 catalyst for hydrogen generation from hydrous hydrazine decomposition
[J].
适于水合肼分解制氢的Ni-Pt/CeO2催化剂的表面组分调控
[J].采用共还原方法制备了Ni-Pt/CeO<sub>2</sub>催化剂,并在不同气氛(空气、H<sub>2</sub>、NH<sub>3</sub>和CO)和不同温度下对催化剂进行热处理。结果表明,改变热处理条件可调变催化剂表面Ni/Pt摩尔比,进而调控催化性能,Ni-Pt/CeO<sub>2</sub>催化剂表面的Ni/Pt摩尔比为0.8~1.14时,催化剂具有较高的催化活性。此外,在催化剂表面引入非金属元素N可大幅度提高Ni-Pt/CeO<sub>2</sub>的催化活性,该发现有望为发展高性能水合肼分解制氢催化剂提供新的思路与途径。
Cr2O3-modified NiFe nanoparticles as a noble-metal-free catalyst for complete dehydrogenation of hydrazine in aqueous solution
[J].
Hydrogen generation from decomposition of hydrous hydrazine over Ni-Ir/CeO2 catalyst
[J].
Mo-doped Ni-based catalyst for remarkably enhancing catalytic hydrogen evolution of hydrogen-storage materials
[J].
Kinetics of catalytic decomposition of hydrous hydrazine over CeO2-supported bimetallic Ni-Pt nanocatalysts
[J].
Evolution of morphologic properties on the preparation of Ir/Al2O3 catalysts with high metallic contents
[J].
Kinetics of Ru-catalyzed sodium borohydride hydrolysis
[J].
Preparation of Ni-Pt/La2O3 catalyst and its kinetics study of hydrous hydrazine for hydrogen generation
[J].
水合肼制氢Ni-Pt/La2O3催化剂研制及其反应动力学研究
[J].综合采用共沉淀和置换法制备了一种La<sub>2</sub>O<sub>3</sub>负载纳米级Ni-Pt合金催化剂Ni-Pt/La<sub>2</sub>O<sub>3</sub>. 经优化制备工艺, 该催化剂在323 K可100%催化N<sub>2</sub>H<sub>4</sub>H<sub>2</sub>O分解制氢, 反应速率340 h<sup>-1</sup>, 其催化性能优于已报道的多数催化剂. 此外, 还对N<sub>2</sub>H<sub>4</sub>H<sub>2</sub>O催化分解制氢反应动力学进行了研究, 得到其反应动力学方程为: r = -d[N<sub>2</sub>H<sub>4</sub>H<sub>2</sub>O]/dt = 2435exp(-51.32/(RT)) [N<sub>2</sub>H<sub>4</sub>H<sub>2</sub>O]<sup>0.3</sup>[NaOH]<sup>0(0.12)</sup>[Ni]<sup>1.03</sup>. 研究结果对于促进N<sub>2</sub>H<sub>4</sub>H<sub>2</sub>O分解制氢体系的实际应用奠定了基础.
Trimetallic nanocatalysts to enhanced hydrogen production from hydrous hydrazine: The role of metal centers
[J].
Hydrous hydrazine decomposition for hydrogen production using of Ir/CeO2: Effect of reaction parameters on the activity
[J].In the present work, an Ir/CeO2 catalyst was prepared by the deposition–precipitation method and tested in the decomposition of hydrazine hydrate to hydrogen, which is very important in the development of hydrogen storage materials for fuel cells. The catalyst was characterised using different techniques, i.e., X-ray photoelectron spectroscopy (XPS), transmission electron microscopy (TEM), scanning electron microscopy (SEM) equipped with X-ray detector (EDX) and inductively coupled plasma—mass spectroscopy (ICP-MS). The effect of reaction conditions on the activity and selectivity of the material was evaluated in this study, modifying parameters such as temperature, the mass of the catalyst, stirring speed and concentration of base in order to find the optimal conditions of reaction, which allow performing the test in a kinetically limited regime.